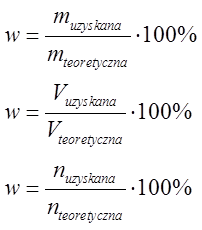
Przykład 1
Oblicz wydajność otrzymywania CH3Cl, jeśli wiesz, że do reakcji użyto 28 dm3 metanu, zaś otrzymano 25 dm3 chlorometanu. Obie objętości zmierzono w warunkach normalnych.- Zaczynamy od zapisania równania reakcji i ewentualnego zbilansowania go. Pozwoli nam to sprawdzić, jak mają się do siebie ilości poszczególnych substancji.
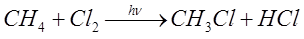
- Obliczamy teoretyczną objętość chlorometanu, czyli taką, która powstałaby w procesie, gdyby nie było żadnych strat.
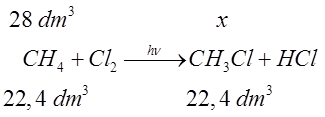
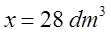
- Obliczamy wydajność reakcji.
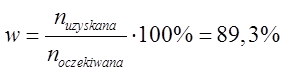
- Odpowiedź: Wydajność reakcji otrzymywania chlorometanu wynosi 89,3%.
Przykład 2
Oblicz objętość chlorometanu otrzymaną z reakcji 28 dm3 metanu z chlorem, jeśli wiesz, że wydajność procesu wynosiła 78%. Obie objętości zostały zmierzone w warunkach normalnych.
- Ponownie - zaczynamy od równania reakcji.
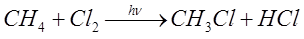
- Obliczamy oczekiwaną objętość chlorometanu, czyli taką, która powstałaby bez strat.
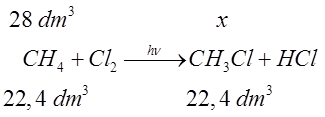
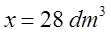
- Obliczamy szukaną objętość na podstawie podanej wydajności.
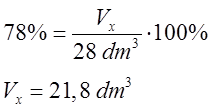
- Odpowiedź: Otrzymana objętość chlorometanu wynosi 21,8 dm3.
Przykład 3
Oblicz objętość metanu potrzebną do otrzymania 30 dm3 chlorometanu podczas reakcji metanu z chlorem, jeśli wydajność procesu wynosiła 88%. Obie objętości zostały zmierzone w warunkach normalnych.- Zapisujemy równanie reakcji.
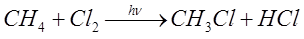
- Obliczamy teoretyczną objętość chlorometanu, czyli taką, która powstałaby przy 100% wydajności.
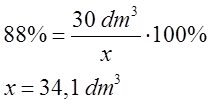
- Obliczamy objętość chlorometanu na podstawie równania reakcji.
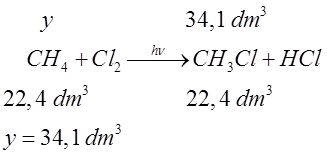
- Formułujemy odpowiedź: objętość użytego metanu to 34,1 dm3
Przykład 4
Otrzymano metanol w dwuetapowej reakcji opisanej następującym schematem: CH4→CH3Cl→CH3OH. Pierwszy proces zachodzi z wydajnością 80%, zaś drugi - 75%. Oblicz masę metanolu, którą otrzymano z 40 dm3 metanu.- Jak zwykle zaczynamy od zapisania równania reakcji. Obu równań, mówiąc ściśle.
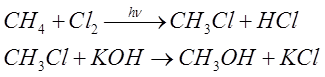
- Dodajemy równania stronami.
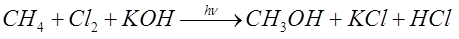
- Obliczamy sumaryczną wydajność reakcji. Jest ona równa iloczynowi poszczególnych wydajności.
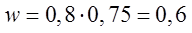
- Obliczamy masę końcową na podstawie sumarycznej wydajności.
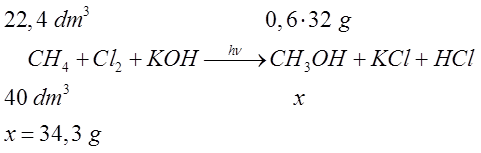
- Podajemy odpowiedź: Z 40 dm3 metanu otrzymano 34,4 g metanolu.
Brak komentarzy:
Prześlij komentarz