Zadania obliczeniowe oparte na równaniach reakcji mają pewien charakterystyczny schemat rozwiązywania. Po rozwiązaniu kilkunastu zadań zaczyna on być logiczny i naturalny, zaś jeśli stosuje się go konsekwentnie, to nawet zadania wyglądające na pierwszy rzut oka na trudne przestają takie być.
- Zapisujemy poprawnie równanie reakcji (dobrym pomysłem jest zapisanie go szeroko. To znaczy, żeby zostawiać przerwy pomiędzy reagentami i wykorzystać całą szerokość kartki. Dzięki temu nie będzie problemu z wpisaniem mas, objętości czy stężeń danych reagentów pod równaniem reakcji) . Uzgadniamy współczynniki stechiometryczne. Jeśli związki są w różnym stanie skupienia albo w postaci roztworów, warto to zaznaczyć odpowiednimi indeksami. Zdarzają się przecież błędy, kiedy ktoś bierze objętość roztworu za objętość substancji i wychodzą mu kompletnie bezsensowne wyniki.
- Podpisujemy ilości związków, które są podane w treści zadania (masy, objętości, stężenia i mole, przy czym ilość moli zapisujemy na górze, zaś resztę na dole). Dobrym pomysłem jest przed wpisaniem ilości przeliczyć wszystko na bardziej „zwyczajne” jednostki, na przykład miligramy na gramy, metry sześcienne na decymetry i tak dalej. Oczywiście przeliczenie to można zrobić później przy okazji dalszych obliczeń, ale wrzucenie zbyt wielu rzeczy w jeden krok może łatwo prowadzić do błędu. Przy przeliczaniu jednostek należy również pamiętać, by nie robić zaokrągleń. Jeśli podane będzie, że do reakcji użyto 2,97 mg jakiejś substancji, to nie jest to 0,003 g! Dobrze jest też robić inteligentne przeliczenia. To znaczy, jeśli w treści zadania mamy wszystko podane w tonach, bo trzeba na przykład obliczyć procent zanieczyszczenia technicznego węglanu sodu to raczej niewskazane będzie przeliczanie tego na gramy. I odwrotnie - jeśli zadanie dotyczy leków i masy podane są w mikrogramach, to już lepiej pozostać przy takich wielkościach i po prostu uważać w następnych krokach obliczania.
- Zakreślamy związek, którego dotyczy pytanie postawione w zadaniu, a następnie pod nim wpisujemy oznaczenie, jakie nadamy szukanej wartości. Dobrze jest sobie wyrobić nawyk nie nazywania każdej szukanej wartości po prostu x, bo nieraz się zdarza, że trzeba obliczyć kilka rzeczy i wtedy nie tylko można się zgubić, ale i sprawdzający może się nie połapać. Chyba najlepszym rozwiązaniem jest po prostu nazwać szukaną wielkość odpowiednią literą (jeśli masa, to m, jeśli objętość to V i tak dalej) z indeksem oznaczającym, jakiego związku dotyczy.
- Przeliczamy na mole wszystko to, co nie jest w molach. Tutaj szczególną uwagę zwracam na gazy – czasem w zadaniu podane jest, że ich objętość nie została zmierzona w warunkach normalnych. Wtedy 22,4 dm3 takiego gazu to nie jeden mol. Wtedy do obliczenia liczby moli trzeba wykorzystać równanie Clapeyrona.
- Teraz uważnie przypatrujemy się ilościom moli każdego związku. Mol ma tę przewagę nad innymi jednostkami, że umożliwia porównanie ilości różnych substancji i łatwe określenie, która z nich występuje w nadmiarze albo ile moli produktów czy substratów wchodzi do reakcji. Między innymi dlatego w wielu zadaniach chemik nic tylko przelicza na mole. Wracając do tematu - jest to chyba kluczowy etap rozwiązywania zadania. Bez względu na to, czy było pytanie o nadmiar substratu, który pozostanie po reakcji, ilość produktu, który się wytworzy albo masę substratów, których musimy użyć do otrzymania zadanej ilości produktu: wszystko to można wyciągnąć właśnie z obliczonych moli. Ich liczba jest proporcjonalna do stechiometrii reakcji, dlatego w tym etapie wpisujemy liczbę moli interesujących nas związków nad ich symbolami w równaniu.
- Co, jeśli któregoś ze związków jest nadmiar? Jak o tym nie zapomnieć i nie pogubić się w obliczeniach? Całkiem dobrym sposobem jest napisanie go również po drugiej stronie strzałki i zapisanie nad nim ile moli pozostało po reakcji. Co prawda nie powinno się tego robić w równaniach reakcji, ale ujęcie w nawias dodatkowego "produktu" albo napisanie go trochę bardziej z boku, gdzieś na marginesie, powinno wyjaśnić sprawę. Raczej lepiej to trzymać w formie własnych notatek do zadania, niż elementu poprawnego rozwiązania.
Przykład 1
Oblicz objętość tlenku węgla (IV) wydzieloną (warunki normalne) podczas reakcji 33 g węglanu sodu z kwasem solnym.
- Zadanie zawsze rozpoczynamy od poprawnego zapisania równania reakcji oraz uzgodnienia współczynników po obu stronach.
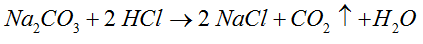
- Następnie podkreślamy ten związek, którego ilość była podana w treści zadania i podpisujemy ową ilość. Uwaga na jednostki! Nie wolno o nich zapomnieć.
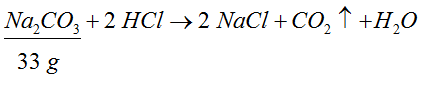
- W kolejnym kroku oznaczamy związek, którego dotyczy postawione w zadaniu pytanie i podpisujemy go wybranym oznaczeniem.
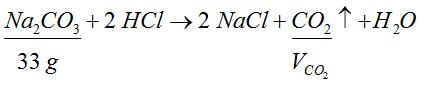
- Obliczamy ilość moli substancji, której masa lub objętość została podana. Gdybyśmy mieli podane mole oszczędziłoby nam to pracy, ale niestety nie tym razem.
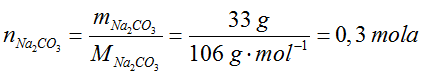
- Dopisujemy obliczoną ilość moli do równania.
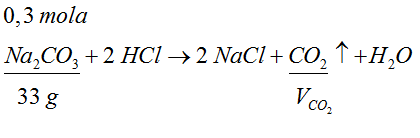
- Na podstawie współczynników stechiometrycznych widać, że na jedną reagującą cząsteczkę węglanu sodu przypada jedna powstająca cząsteczka tlenku węgla (IV). Oznacza to, że ilość moli CO2 jest równa ilości moli Na2CO3.
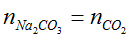
- Stąd już tylko krok do uzyskania odpowiedzi na pytanie postawione w zadaniu. Mając daną ilość moli gazu i wiedząc, że reakcja zachodziła w warunkach normalnych, możemy obliczyć objętość wydzielonego CO2.
- Odpowiedź: W reakcji wydziela się 6,79 dm3 tlenku węgla (IV).
Przykład 2
Oblicz masę osadu wydzielonego podczas reakcji 43 g 12% kwasu siarkowego (VI) z wodorotlenkiem baru.
- Zapisujemy równanie reakcji.
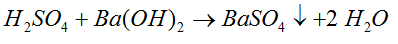
- Obliczamy, jaka ilość kwasu siarkowego znajduje się w roztworze. Przyjmujemy, że ilość wodorotlenku jest wystarczająca do reakcji, ponieważ nie podano żadnych danych dotyczących tego.
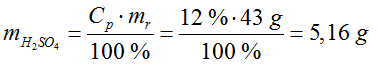
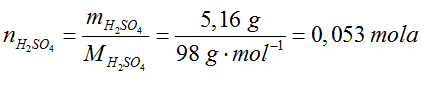
- Wpisujemy ilość moli związków nad ich symbole w równaniu reakcji.
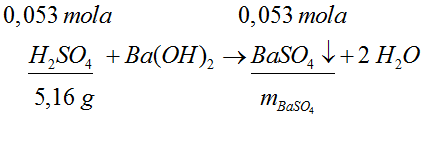
- Obliczamy masę osadu.
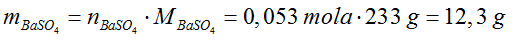
- Odpowiedź: W reakcji powstanie 12,3 g siarczanu (VI) baru.
Przykład 3
Do 500 dm3 wodnego roztworu kwasu azotowego (V) o stężeniu 0,8 mol/dm3 wtłoczono 30 dm3 amoniaku odmierzonego w warunkach normalnych. Oblicz masę powstałego azotanu (V) amonu.
- Jak zwykle zaczynamy od zapisania równania reakcji.
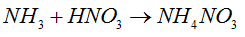
- Następnie obliczamy ilość moli związku zawartej w podanym roztworze.
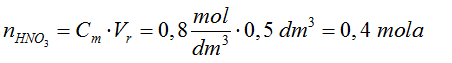
- Obliczamy liczbę moli amoniaku.
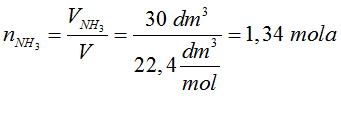
- Na podstawie równania reakcji określamy, która substancja występuje w niedomiarze i na jej podstawie obliczamy masę soli.
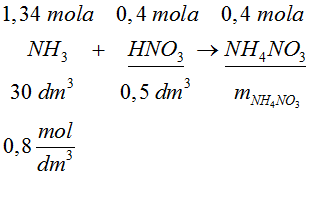
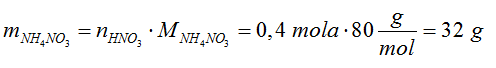
- Odpowiedź: Powstaną 32 g azotanu (V) amonu.
W przykładzie 3. powinno być chyba 500 cm3, bo dalej występuje 0.5dm3
OdpowiedzUsuńJeśli wykorzystamy w obliczeniach wartość 5oo dm3 wynik wyjdzie - 3200 g azotanu (V) zmonu
OdpowiedzUsuńO - fantastyczny sposób obliczenia.. dzięki!
OdpowiedzUsuń