Szybkość reakcji
Równanie kinetyczne opisuje zależność między chwilową szybkością reakcji a stężeniami reagentów. Ma ono postać:
\[
v = k \cdot [A]^{x} \cdot [B]^{y}
\]
gdzie [A] oraz [B] to stężenia molowe substratów. Wielkość k jest nazywana stałą szybkości reakcji.
Na podstawie równania kinetycznego można przewidzieć, jak będzie zmieniać się szybkość reakcji po zmianie warunków tej reakcji.
Przykład 1
Dana jest reakcja tworzenia tlenku azotu z następujących składników:
\[
2 NO + O_{2} \rightarrow 2 NO_{2}
\]
Na tej podstawie napisz równanie kinetyczne oraz określ jej rzędowość. Czy zawsze można napisać równanie kinetyczne mając dane równanie reakcji procesu?
- Zaczynamy od równania kinetycznego. \[ v = k \cdot [NO]^{2} \cdot [O_{2}] \]
- Określamy rzędowość reakcji. Sumujemy wykładniki potęg w równaniu kinetycznym i widzimy, że podana reakcja jest III rzędu.
- Równanie kinetyczne ustala się ostatecznie zawsze doświadczalnie. Złożone, wieloetapowe reakcje nie dają się tak łatwo zapisać i ich równanie kinetyczne często ma inną postać, niż sugerowałoby to sumaryczne równanie reakcji.
- Odpowiedź: reakcja jest III rzędu.
Przykład 2
Szybkość reakcji hydrolizy sacharozy jest dana następującym równaniem kinetycznym:
\[
v = k \cdot [C_{12}H_{22}O_{11}] \cdot [H^{+}]
\]
Oblicz, jak zmieni się szybkość reakcji, jeżeli stężenie cukru wzrośnie dwukrotnie, a stężenie jonów wodorowych wzrośnie czterokrotnie.
- Zaczynamy od zapisania równania kinetycznego na szybkość początkową pierwszego układu. \[ v_{1} = k \cdot [C_{12}H_{22}O_{11}] \cdot [H^{+}] \]
- Zapisujemy analogiczne równanie dla stężeń po zmianie warunków: \[ v_{2} = k \cdot 2[C_{12}H_{22}O_{11}] \cdot 4[H^{+}] \]
- Przyrównujemy obie szybkości reakcji. \[ \frac{v_{2}}{v_{1}} = \frac{k \cdot 2[C_{12}H_{22}O_{11}] \cdot 4[H^{+}]}{k \cdot [C_{12}H_{22}O_{11}] \cdot [H^{+}]} = 8 \]
- Odpowiedź: Szybkość reakcji wzrośnie ośmiokrotnie.
Reakcja I rzędu
Reakcje pierwszego rzędu to takie, których szybkość zależy tylko od stężenia jednego substratu i to w pierwszej potędze. Takimi reakcjami są reakcje samoistnego rozpadu molekuł lub zmiany ich konfiguracji (np. jak to ma miejsce w cząsteczce amoniaku, która składa się jak parasol pod wpływem silnego wiatru). Najbardziej sztandarowym przykładem reakcji I rzędu są jednak rozpady promieniotwórcze. W ich wypadku stężenie substratu można śmiało zastąpić masą materiału promieniotwórczego.
Przy tych reakcjach można się posłużyć równaniem kinetycznym zapisanym w następujący sposób:
\[
ln\frac{C_{0}}{C} = k \cdot t\\
[C] = [C_{0}] \cdot e^{-k\cdot t}\\
ln[C] = ln[C_{0}] - k \cdot t\\
k = \frac{ln2}{t_{1/2}}
\]
gdzie t½ to czas połowicznego rozpadu, czyli czas, po którym zanika połowa materiału promieniotwórczego. Jest to wielkość charakterystyczna dla danej substancji.
Przykład 3
Oblicz masę promieniotwórczego izotopu, jaki pozostał po tygodniu przechowywania próbki o masie 12 g, jeżeli jej czas połowicznego rozpadu wynosi 3 dni.
- Zaczynamy od obliczenia stałej szybkości reakcji. \[ k = \frac{ln2}{3\;dni} = 0,231 \frac{1}{dzień} \]
- Rozpisujemy odpowiednią zależność i obliczamy. \[ [m] = [m_{0}] \cdot e^{-k\cdot t}\\ [m] = 12 \cdot e^{- 0,231 \frac{1}{dzień} \cdot 7 \; dni}\\ m = 2,38 g \]
- Odpowiedź: po tygodniu pozostanie 2,38 g próbki.
Przykład 4
Na podstawie wykresu oszacuj masę promieniotwórczego izotopu, jaki pozostał po tygodniu przechowywania próbki o masie 12 g, jeżeli czas połowicznego rozpadu wynosił 3 dni.
- Zaczynamy od przygotowania tabeli zależności masy próbki od czasu przechowywania.
Czas przechowywania [dni] 0 3 6 9 12 Masa pozostałego izotopu [g] 12 6 3 1,5 0,75 - Następnie rysujemy odpowiedni wykres.
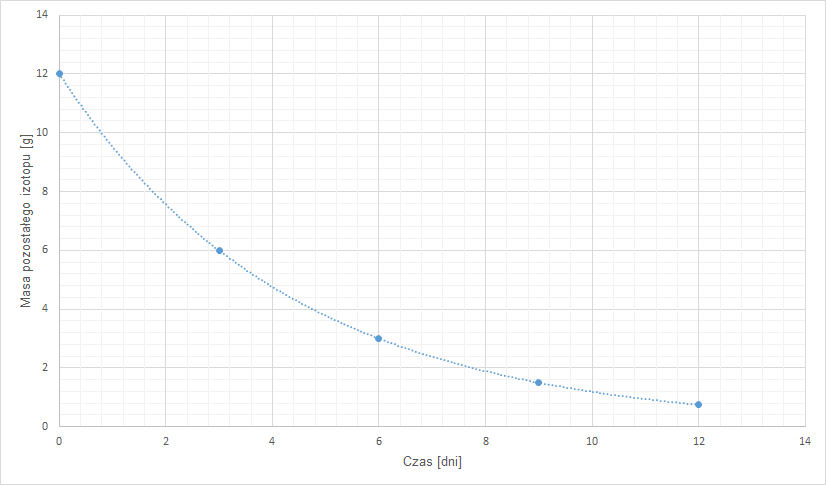
- Odczytujemy z wykresu masę.
- Odpowiedź: po tygodniu pozostanie około 2,5 g próbki.
Brak komentarzy:
Prześlij komentarz